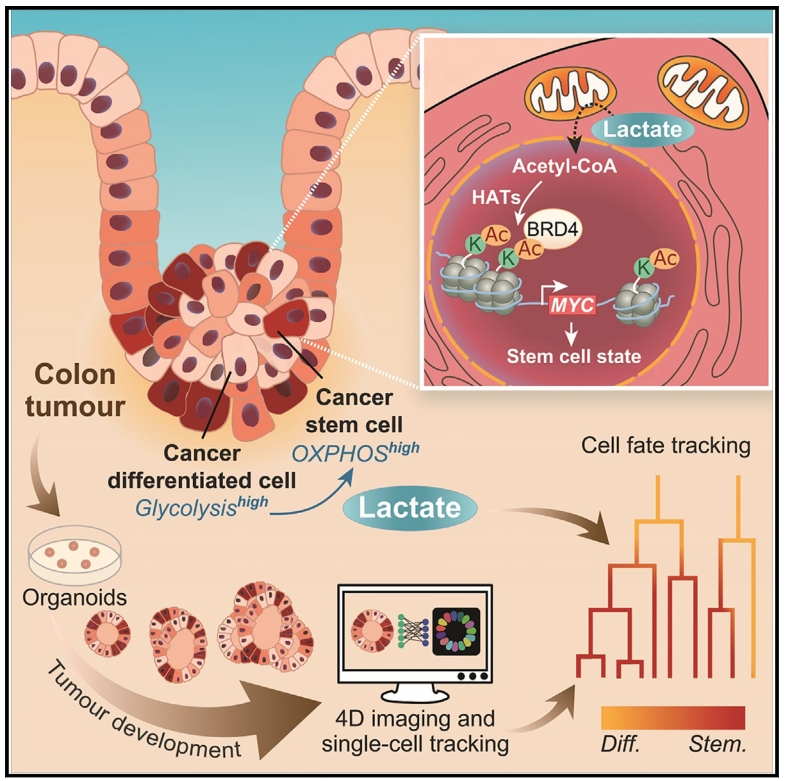
上皮组织靠干细胞自我更新维持功能,干细胞通路突变易致肿瘤。在肠道中,WNT(配体蛋白质Wnt和膜蛋白受体结合激发的一组多下游通道的信号转导途径)信号是干细胞状态的关键开关(调节因子),要是这个 “开关” 被疯狂按下(过度激活),就会推动肿瘤发生。结直肠肿瘤保留部分起源组织结构,存在“领导型的”癌干细胞(CSCs)和“下属型”癌分化细胞(CDCs)。CSCs具有高WNT活性和强增殖能力,可分化为CDCs。CSCs在肿瘤生长中的作用明确,但CDCs的作用未知,其广泛存在暗示对结直肠癌(CRC)进展有重要贡献。CDCs去分化为CSCs的细胞可塑性在CSCs耗尽时被观察到,可恢复肿瘤生长潜力。这些过程在体内和体外类器官中均存在,由肿瘤细胞协调,但其对治疗耐药性和复发的影响及调控机制尚未明确。此前研究发现肠细胞有独特代谢表型,乳酸可在细胞间交换,但肿瘤细胞代谢表型及其对细胞命运的影响尚不清楚。
基于此,荷兰乌得勒支大学医学中心Maria J. Rodríguez Colman实验室等在Cell Metabolism发表题为“Lactate controls cancer stemness and plasticity through epigenetic regulation”的研究文章,揭示乳酸依赖表观遗传调控因子MYC和BRD4,通过抑制分化和激活CDCs回归CSC状态,增加CSCs群体,表明乳酸是维持CSC群体和调控MYC影响肿瘤发展的关键因子。
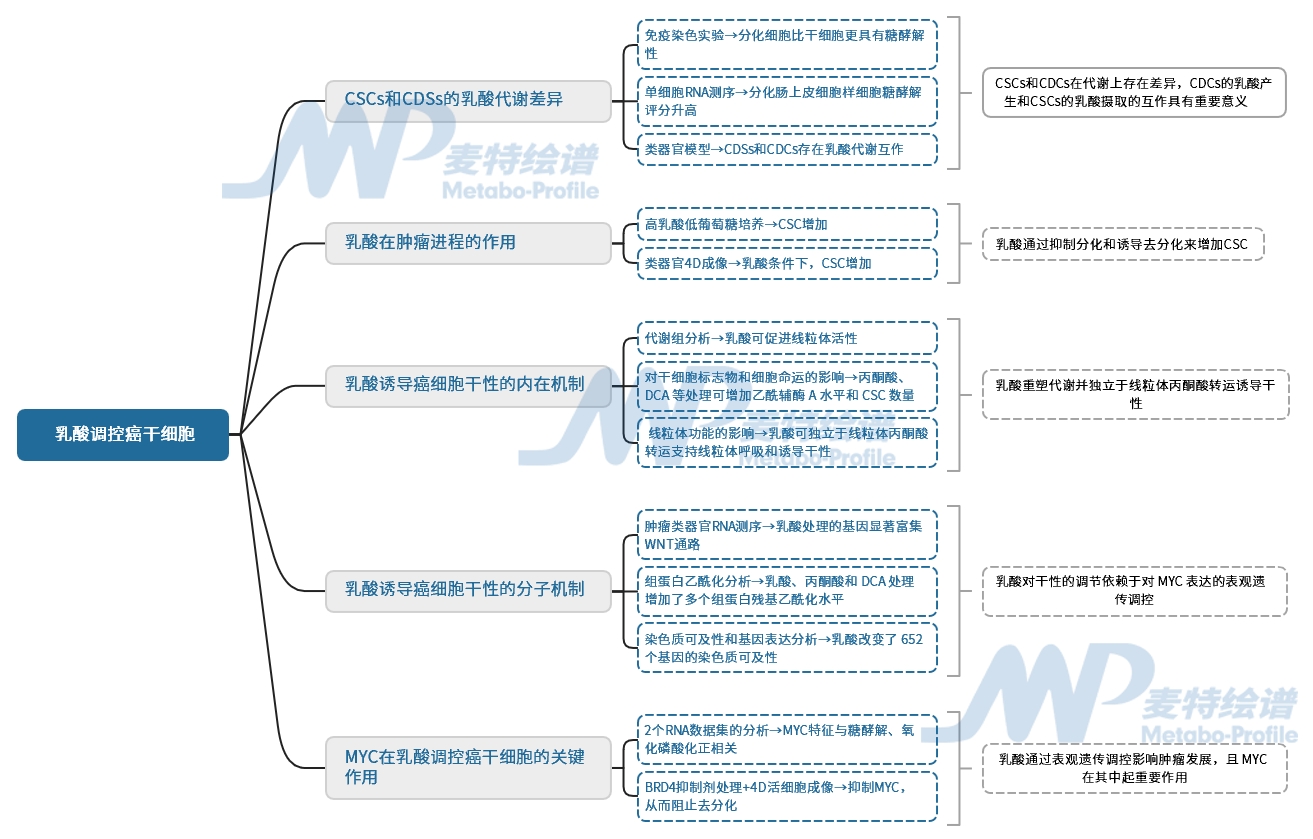
研究思路图
研究结果
1. CSCs和CDCs显示出不同的乳酸代谢
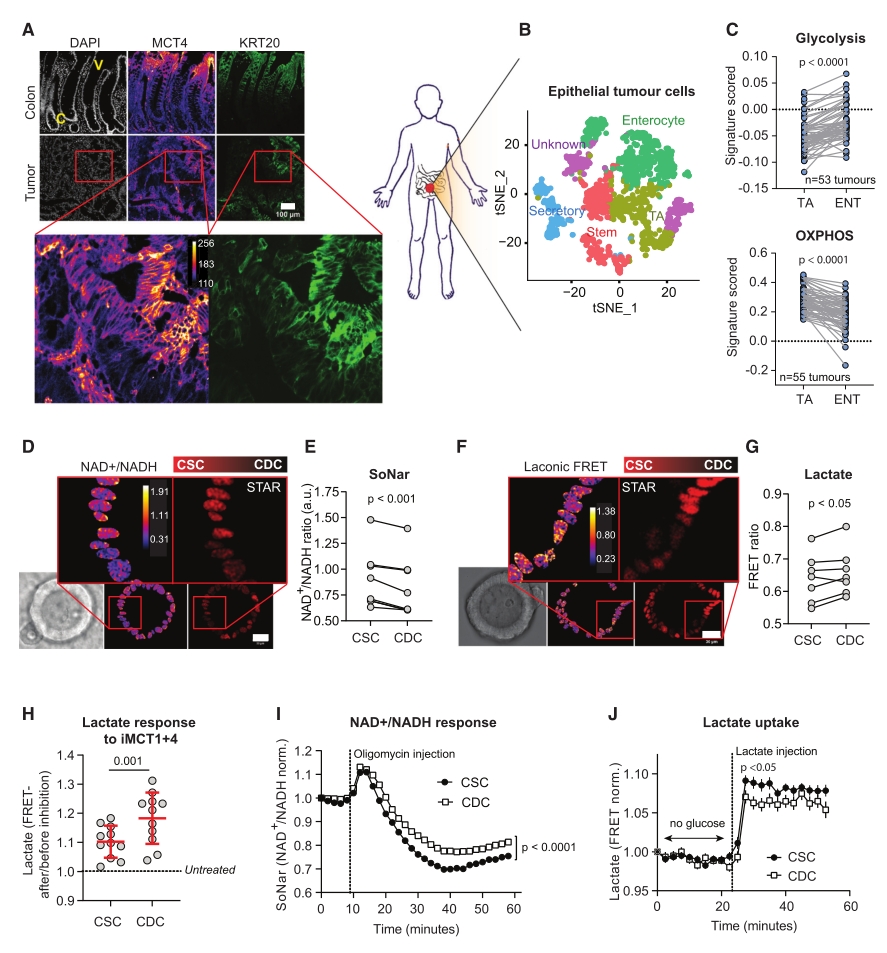
先前研究发现,小鼠肠道干细胞和分化细胞存在代谢差异,人类结肠和结肠肿瘤中也存在类似代谢差异,免疫染色显示分化细胞比干细胞表达更高水平的MCT4,提示其更具糖酵解性。肿瘤细胞中,CDCs的MCT4水平更高,表明肿瘤内细胞代谢存在差异。对60个肿瘤样本进行单细胞RNA测序,结果发现肿瘤细胞存在干细胞样、TA样、肠上皮细胞样和分泌细胞样等类型,其中分化肠上皮细胞样细胞糖酵解评分升高,TA样细胞线粒体代谢评分最高。类器官模型显示CSCs的NAD+/NADH比值高于CDCs,CDCs乳酸分泌更多,CSCs乳酸摄取能力更强,提示两者存在代谢互作。这些结果表明,CSCs和CDCs在代谢上存在差异,CDCs的乳酸产生和CSCs的乳酸摄取可能在肿瘤发展中发挥重要作用。
图1. CSCs和CDCs显示出不同的乳酸代谢
2. 乳酸通过抑制分化和诱导去分化来增加CSC
肿瘤微环境的特征包括低葡萄糖和高乳酸,结果1已经表明,CDCs和CSCs通过乳酸相互作用。因此,作者进一步研究乳酸在肿瘤发展中的作用。
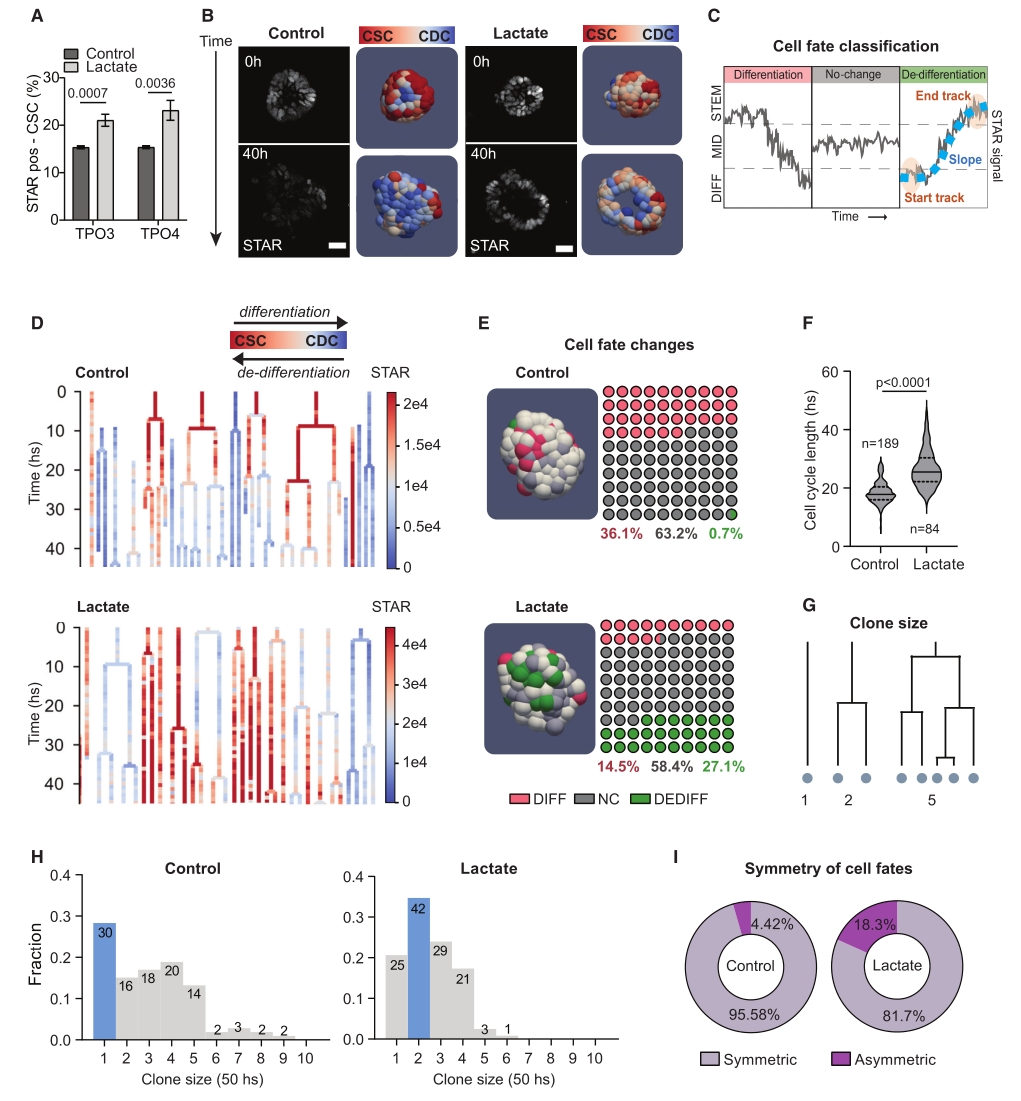
研究发现,高水平乳酸和低水平葡萄糖培养细胞,能显著增加CSC群体,降低分化标志物表达,增加干细胞标志物表达,且在TPO3中更明显。而单独降低葡萄糖无法重现该表型;而抑制MCT转运蛋白导致细胞内乳酸积累,也增加CSC数量,表明细胞外和内源性乳酸均促进CSC特性。
4D成像显示,对照条件下,类器官中CSC比例随时间减少;而乳酸条件下,细胞分化减少50%,去分化显著增加。细胞的周期延长,类器官大小无显著差异(乳酸增加了增殖性,CSC数量平衡了生长率)。在稳态下,肠道干细胞对称分裂,乳酸使不对称细胞命运频率增至18.3%,主要是姐妹细胞去分化。这些结果表明,乳酸通过抑制分化、诱导CDCs回归到增殖性CSC状态来促进CSCs,揭示了乳酸水平升高在肿瘤发展中的重要作用。
图2. 乳酸通过抑制分化和诱导去分化来增加CSC
3. 乳酸重塑代谢并独立于线粒体丙酮酸转运诱导干性
为了探究乳酸诱导干细胞特性的内在机制,作者研究分析了乳酸对代谢组的影响。结果发现,乳酸处理后,代谢组发生变化,糖酵解中间产物减少,TCA循环中间产物增加,丙酮酸和乙酰辅酶 A 水平显著升高,表明乳酸可促进线粒体活性。
研究也发现,丙酮酸、DCA等处理可增加乙酰辅酶A水平和CSC数量,抑制细胞分化,增强去分化,诱导不对称细胞命运,这些作用与乳酸类似。
此外,虽然线粒体活性对诱导癌症干性很重要,但阻断线粒体丙酮酸载体(MPC)并不能逆转乳酸等诱导的CSC增加,说明乳酸可独立于线粒体丙酮酸转运支持线粒体呼吸和诱导干性。
综上,乳酸通过驱动代谢重编程,增加线粒体呼吸作用和TCA循环中间体水平,从而诱导癌症干细胞特性,且线粒体活性在这一过程中发挥关键作用。
图3. 乳酸通过重编程代谢并诱导干细胞特性,且这一过程不依赖于线粒体丙酮酸的摄取
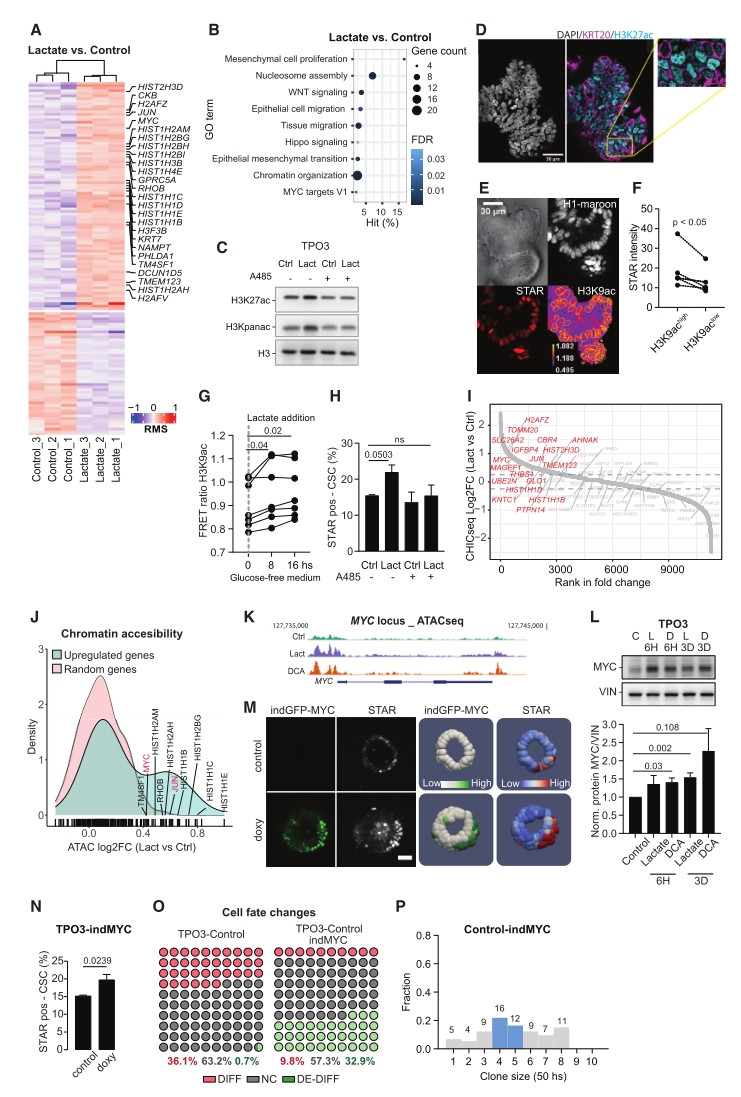
4. 乳酸增强了MYC位点的组蛋白乙酰化和染色质可及性
转录重编程在调控细胞类型特异性中起关键作用。对肿瘤类器官RNA测序分析显示,乳酸处理后,差异显著的基因主要富集于WNT信号通路、细胞增殖、迁移以及与染色质重塑相关等类别。
染色质重塑因子活性受底物和辅因子可用性调控。组蛋白乙酰化分析显示,乳酸、丙酮酸和DCA处理增加了多个组蛋白残基(H3pan、H3K27、H3K9)的乙酰化水平,且这种作用依赖于乙酰转移酶活性。免疫荧光和FRET报告基因分析显示,CSCs中的组蛋白乙酰化水平高于CDCs,抑制组蛋白乙酰化可抵消乳酸和DCA增加CSC的作用。
ATAC分析表明,乳酸改变了652个基因的染色质可及性,其中90%的基因可及性增加,包括MYC等癌基因和WNT通路的转录因子。诱导MYC表达可模拟乳酸诱导的表型,表明乳酸对干性的调节依赖于对MYC表达的表观遗传调控。
图4. 乳酸增强了MYC位点的组蛋白乙酰化和染色质可及性
5. 乳酸诱导的干性和可塑性依赖于MYC
分析两个RNA数据集(290和96个肿瘤样本),发现MYC特征与糖酵解、氧化磷酸化正相关。单细胞水平上,MYC特征评分在不同细胞类型间有差异,TA样细胞评分最高,CDCs糖酵解评分更高,且MYC与糖酵解特征无相关性。乳酸诱导的“MYC激活”状态由糖酵解型CDCs等细胞创造的高乳酸环境支持,促进氧化型、增殖型CSCs发生。
乳酸对MYC及干细胞特性的影响受表观遗传调控。BRD4抑制剂可改变基因表达,抑制MYC及其特征基因,阻止乳酸和DCA增加CSC群体。4D活细胞成像显示,BRD4抑制部分挽救乳酸诱导的分化抑制,显著阻止去分化至CSC状态,逆转不对称细胞分裂,阻止细胞周期延长。
使用MYC抑制剂和MYC敲低细胞系,发现二者均部分逆转乳酸诱导的CSC增加和去分化,降低不对称细胞命运频率,减少克隆大小,延长细胞周期。诱导MYC表达对CSC增加有加成作用但不显著。因此乳酸通过表观遗传调控影响肿瘤发展的关键方面,包括增殖、干细胞特性和癌细胞可塑性。
图5. 乳酸诱导的干性和可塑性依赖于MYC
小结
通过人源肿瘤类器官及机器学习技术发现,乳酸作为代谢信号可维持癌干细胞(CSC)干性并驱动癌分化细胞(CDC)逆分化。机制上,乳酸通过诱导组蛋白修饰激活BRD4-MYC信号轴,以此增强CSC特性及肿瘤细胞可塑性。鉴于BRD4是该调控通路的核心节点,研发靶向BRD4的小分子药物有望精准抑制CSC干性,为阻断肿瘤复发提供新策略。
参考文献
Lactate controls cancer stemness and plasticity through epigenetic regulation. Cell Metabolism. 2025
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱已为数百家三甲医院、科研院所和企业提供多组学一站式整体解决方案,协助客户与合作伙伴发表SCI文章500+篇,累计影响因子5000+,平均IF>10,涵盖Cell, Science, Nature, Cancer Cell, Signal Trans-duction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等顶级期刊。